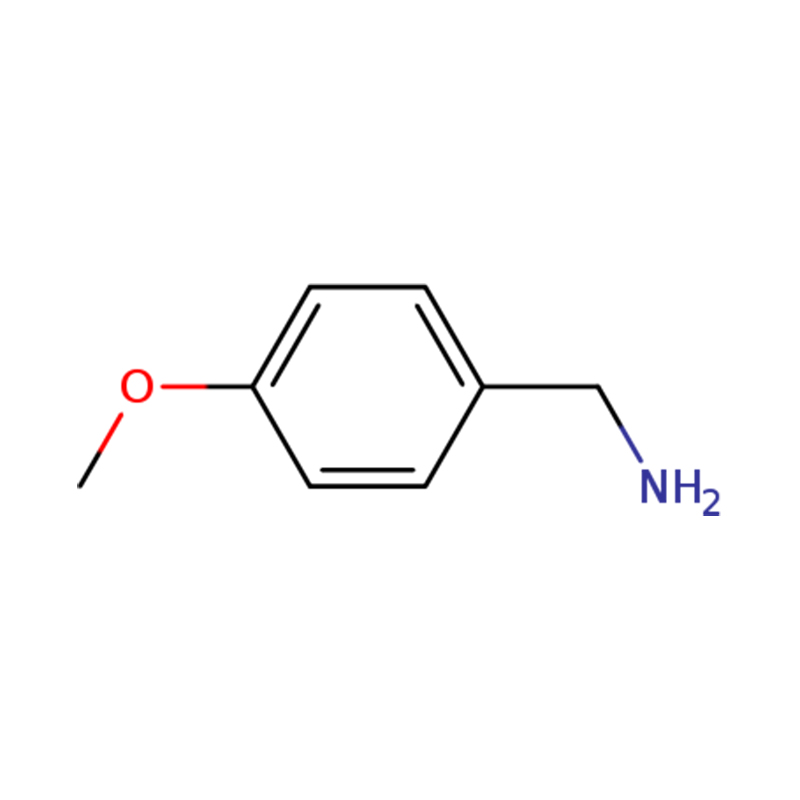
1-(4-METOXIFENIL)METANAMINA
Detalle do produto
| Nº de caixa | 2393-23-9 | Tempo de entrega | dentro de 10 días |
| Molecular | C8H11NO | capacidade de produción | 1 tonelada métrica/día |
| Aparencia | Líquido transparente, incoloro ou lixeiramente amarelo | Pureza | 99% mín. |
| Aplicación | Intermedios farmacéuticos | Almacenamento | Temperatura ambiente, escuro, selado |
| Número límite | 1 quilogramo | Transporte | Aire, Marítimo, Exprés. |
| Densidade | 1,05 g/mLat25 °C (lit.) | Punto de ebulición | 236-237 °C (lit.) |
| Ponit de fusión | -10 °C | Índice de refracción | n20/D1.546 (literal) |
| Punto de inflamación: | >121 °C | Solubilidade | Moi soluble en auga |
| Nome | p-anisilamina ou (4-metoxifenil)metanamina |
Sinónimos
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETIL-ANISOL; 4-METOXIBENCILAMINA; Clorhidrato de P-metoxibencilamina 173,64; 4-metoxibencilamina, 98+%; para esparfloxacina; CLORHIDRATO DE P-METOXIBENCILAMINA
Aplicación
Pódese empregar para a síntese de produtos intermedios farmacéuticos. É lixeiramente nocivo para a auga. Non permita que os produtos sen diluír ou en grandes cantidades entren en contacto con augas subterráneas, vías fluviais ou sistemas de sumidoiros. Sen permiso do goberno, non verta materiais no ambiente circundante para evitar o contacto con óxidos, ácidos, aire ou dióxido de carbono, manteña o recipiente selado, colóqueo nun extractor hermético e gárdeo nun lugar fresco e seco.
Laboratorio de control de calidade
Un laboratorio individual de control de calidade atópase no lugar onde se realizan probas químicas e físicas, probas microbianas, estudos de estabilidade e probas de instrumentos como IR, UV, HPLC e GC para materias primas e produtos acabados. Toda a área ten control de acceso e está ben mantida, con instrumentos analíticos suficientes para o propósito das probas previsto. Todos os instrumentos están ben etiquetados e calibrados axeitadamente.
QA
O control de calidade é responsable de avaliar e clasificar a desviación en nivel maior, nivel xeral e nivel menor. Para todos os niveis de desviación, é necesaria unha investigación para identificar a causa raíz ou a causa potencial. A investigación debe completarse nun prazo de 7 días hábiles. A avaliación do impacto do produto xunto co plan de acción preventiva e de prevención do impacto do produto tamén se requiren unha vez completada a investigación e identificada a causa raíz. A desviación péchase cando se implementa a acción preventiva e de prevención do impacto do produto. Todas as desviacións de nivel deben ser aprobadas polo xestor de control de calidade. Unha vez implementada, a eficacia da acción preventiva e de prevención do impacto do produto confírmase segundo o plan.