Antecedentes e deseño do estudo
A retatrutida (LY3437943) é un novo fármaco dun só péptido que activatres receptores simultaneamenteGIP, GLP-1 e glicagón. Para avaliar a súa eficacia e seguridade en individuos con obesidade pero sen diabetes, realizouse un ensaio de fase 2, aleatorizado, dobre cego e controlado con placebo (NCT04881760). Un total de338 participantescun IMC ≥30 ou ≥27 con polo menos unha comorbilidade relacionada co peso, foron aleatorizados para recibir placebo ou retatrutida (1 mg, 4 mg con dous esquemas de titulación, 8 mg con dous esquemas de titulación ou 12 mg) administrado unha vez por semana por inxección subcutánea durante 48 semanas. Ocriterio de valoración principalfoi a porcentaxe de cambio no peso corporal ás 24 semanas, con criterios de valoración secundarios que incluían o cambio de peso ás 48 semanas e limiares de perda de peso categóricos (≥5 %, ≥10 %, ≥15 %).
Resultados clave
-
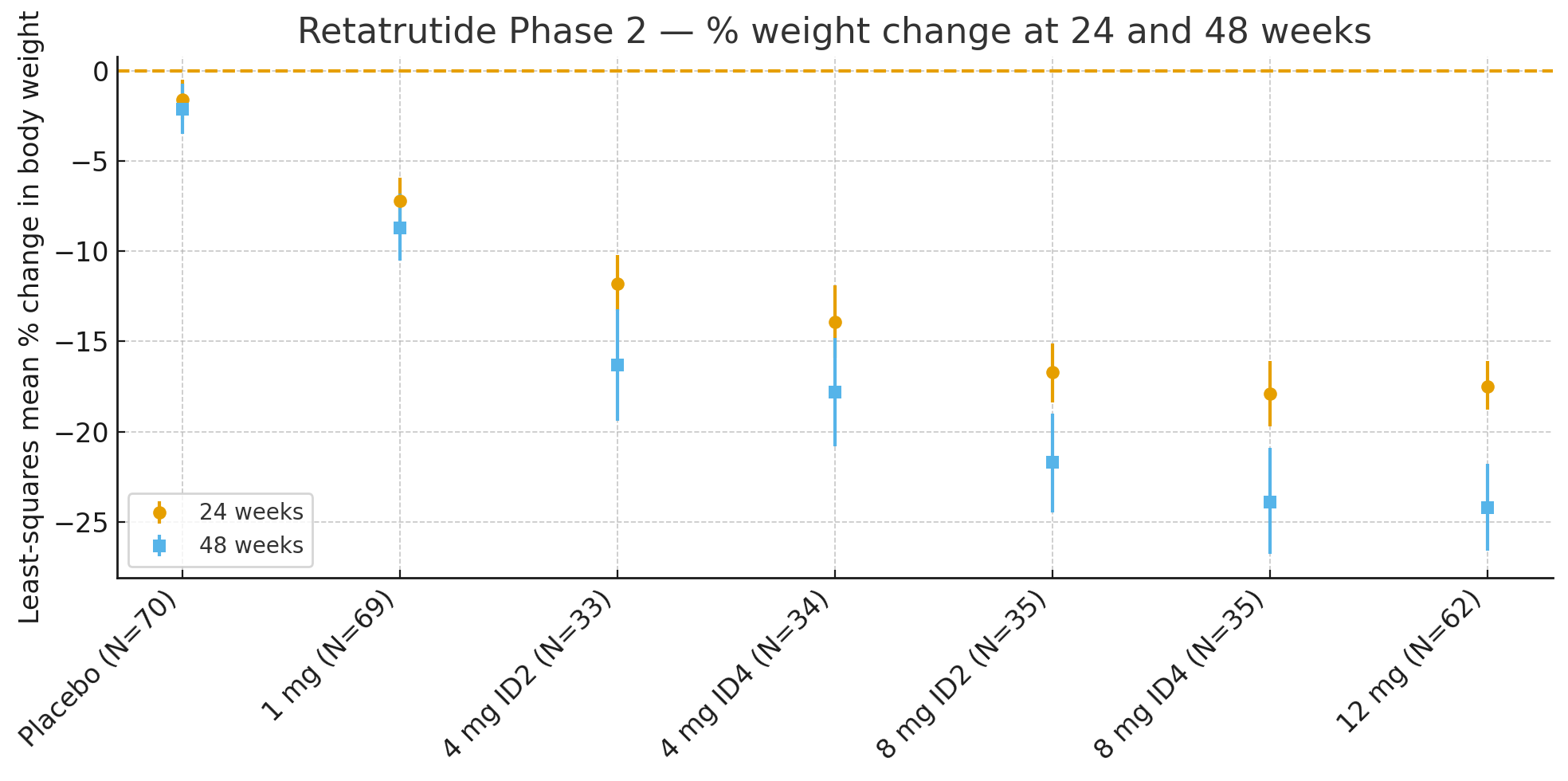
24 semanasA porcentaxe media de cambio no peso corporal en relación coa liña base foi de mínimos cadrados
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (combinados): −12,9%
-
8 mg (combinados): −17,3%
-
12 mg: −17,5%
-
-
48 semanas: A porcentaxe de cambio no peso corporal foi
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (combinados): −17,1%
-
8 mg (combinados): −22,8%
-
12 mg: −24,2%
-
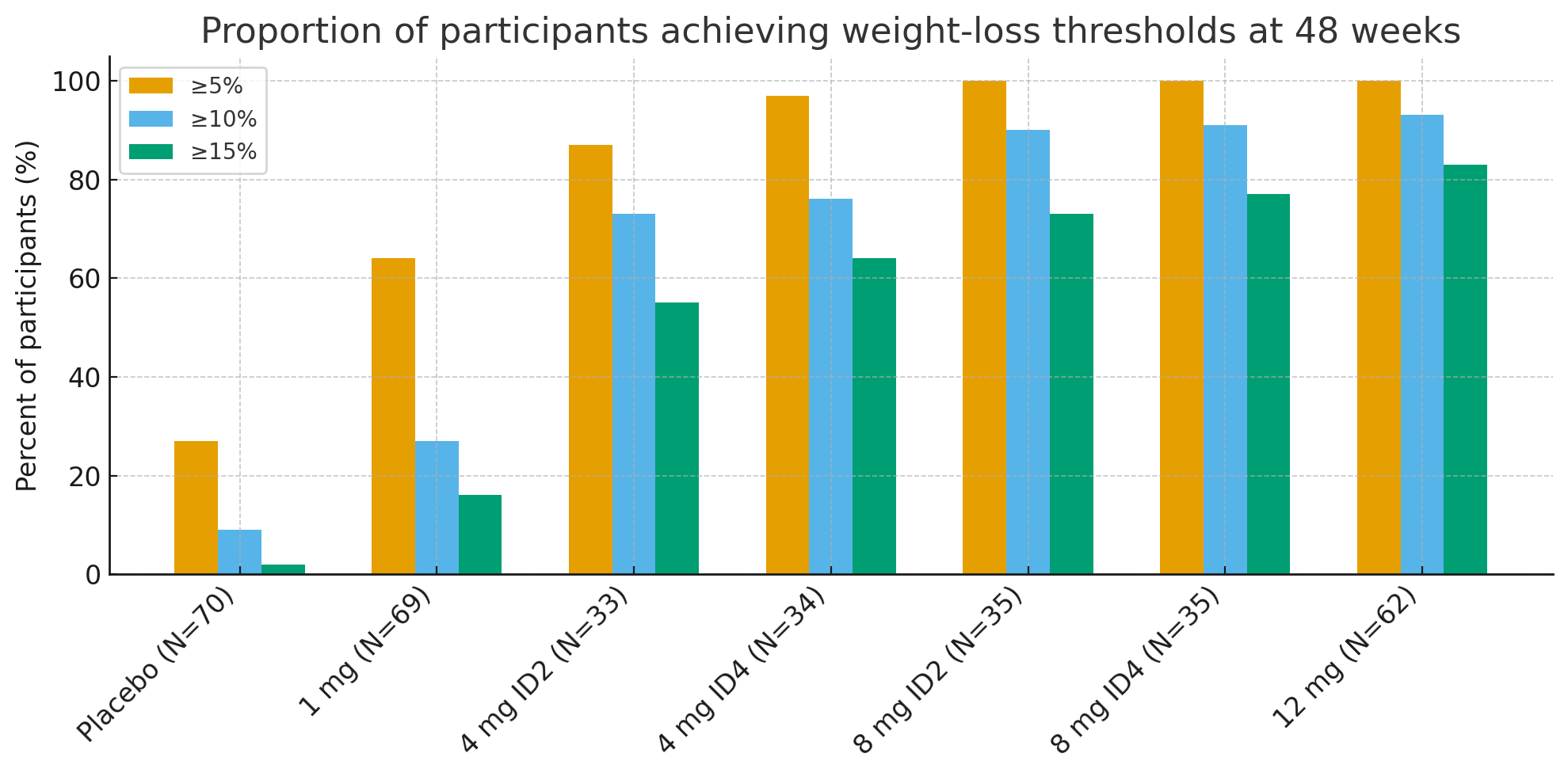
Ás 48 semanas, as proporcións de participantes que alcanzaron limiares de perda de peso clinicamente significativos foron sorprendentes:
-
Perda de peso ≥5 %: 27 % con placebo fronte a 92–100 % nos grupos activos
-
≥10%: 9% con placebo fronte a 73–93% nos grupos activos
-
≥15%: 2% con placebo fronte a 55–83% nos grupos activos
No grupo de 12 mg, ataO 26 % dos participantes perderon ≥30 % do seu peso basal, unha magnitude de perda de peso comparable á cirurxía bariátrica.
Seguridade
Os eventos adversos máis comúns foron gastrointestinais (náuseas, vómitos, diarrea), xeralmente leves a moderados e relacionados coa dose. As doses iniciais máis baixas (titulación de 2 mg) reduciron estes eventos. Observáronse aumentos na frecuencia cardíaca relacionados coa dose, que alcanzaron o máximo na semana 24 e logo diminuíron. As taxas de interrupción oscilaron entre o 6 e o 16 % nos grupos activos, algo superiores ás do placebo.
Conclusións
En adultos con obesidade sen diabetes, a retatrutida subcutánea semanal durante 48 semanas produciureducións substanciais e dependentes da dose no peso corporal(ata unha perda media de ata ~24 % na dose máis alta), xunto con melloras nos marcadores cardiometabólicos. Os eventos adversos gastrointestinais foron frecuentes pero manexables coa titulación. Estes achados da fase 2 suxiren que a retatrutida podería representar un novo punto de referencia terapéutico para a obesidade, pendente de confirmación en ensaios de fase 3 máis amplos e a longo prazo.
Data de publicación: 28 de setembro de 2025